-
 儀表網(wǎng)手機(jī)版
儀表網(wǎng)手機(jī)版
手機(jī)訪問(wèn)更快捷
 儀表網(wǎng)小程序
儀表網(wǎng)小程序
更多流量 更易傳播
-
公眾號(hào).jpg) 公眾號(hào):ybzhan
公眾號(hào):ybzhan
隨時(shí)掌握行業(yè)動(dòng)態(tài)
 掃碼關(guān)注視頻號(hào)
掃碼關(guān)注視頻號(hào)
網(wǎng)絡(luò)課堂 行業(yè)直播
 儀表網(wǎng)手機(jī)版
儀表網(wǎng)手機(jī)版
手機(jī)訪問(wèn)更快捷
 儀表網(wǎng)小程序
儀表網(wǎng)小程序
更多流量 更易傳播
公眾號(hào).jpg) 公眾號(hào):ybzhan
公眾號(hào):ybzhan
隨時(shí)掌握行業(yè)動(dòng)態(tài)
 掃碼關(guān)注視頻號(hào)
掃碼關(guān)注視頻號(hào)
網(wǎng)絡(luò)課堂 行業(yè)直播
產(chǎn)品推薦:水表|流量計(jì)|壓力變送器|熱電偶|液位計(jì)|冷熱沖擊試驗(yàn)箱|水質(zhì)分析|光譜儀|試驗(yàn)機(jī)|試驗(yàn)箱
想做DAP-seq實(shí)驗(yàn),卻滿腦子疑問(wèn)?別擔(dān)心,這篇攻略為你一次性解答所有關(guān)鍵問(wèn)題,助你輕松開(kāi)啟實(shí)驗(yàn)之旅!
一、DAP-seq是什么?能幫我解決啥問(wèn)題?
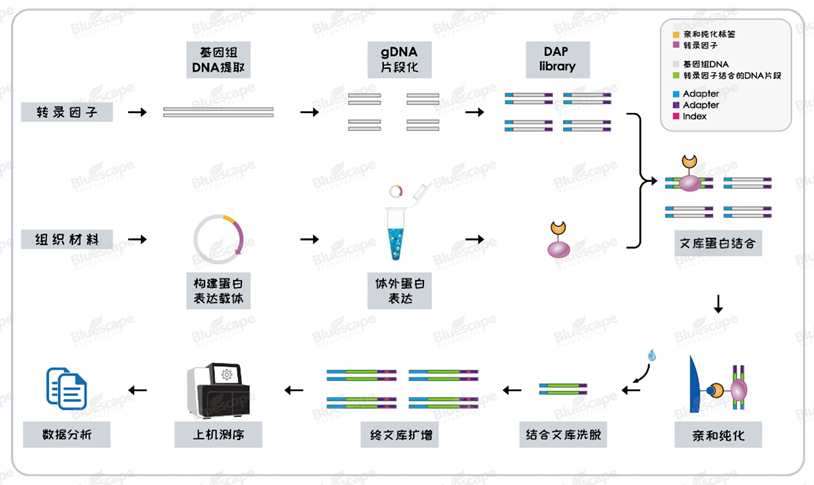
DAP-seq技術(shù)的核心原理
先在體外表達(dá)帶有特定標(biāo)簽(如His、Halo標(biāo)簽)的目的蛋白,讓其與標(biāo)簽配體結(jié)合后,再與基因組DNA共同孵育,最后洗脫結(jié)合的DNA片段進(jìn)行高通量測(cè)序和生物信息分析。
核心優(yōu)勢(shì)
它能幫你快速鎖定轉(zhuǎn)錄因子的結(jié)合位點(diǎn),找到其調(diào)控的下游靶基因。更給力的是,這項(xiàng)技術(shù)無(wú)需特異性抗體,無(wú)需轉(zhuǎn)基因材料,即可揭示轉(zhuǎn)錄因子與DNA的互作網(wǎng)絡(luò),如今已成為植物學(xué)、微生物學(xué)等領(lǐng)域解析基因表達(dá)調(diào)控網(wǎng)絡(luò)的關(guān)鍵技術(shù)手段。
藍(lán)景科信DAP-seq技術(shù)流程
二、實(shí)驗(yàn)前,我需要準(zhǔn)備哪些材料?
(1)樣本材料
- 組織材料:植物組織5g、動(dòng)物組織2g、微生物2g;或提取好的基因組DNA 10μg(可根據(jù)DNA提取效率適當(dāng)調(diào)整樣本量)。
-含有轉(zhuǎn)錄因子CDS序列的質(zhì)粒:需附帶測(cè)序無(wú)誤的報(bào)告(序列準(zhǔn)確性至關(guān)重要,否則會(huì)嚴(yán)重影響實(shí)驗(yàn)周期)。
(2)組織部位如何選取?
若蛋白表達(dá)有組織或時(shí)空特異性,優(yōu)先選擇對(duì)應(yīng)時(shí)期的組織——因?yàn)槲覀兂R?guī)DAP-seq流程采用PCR-free建庫(kù)的方式,盡可能保留DNA修飾,而這些修飾可能影響蛋白與DNA的結(jié)合。
我們已完成3000+項(xiàng)目,植物的根、莖、葉、果實(shí)、種子等組織均有成功提取經(jīng)驗(yàn)。若提取失敗,可更換易提取的組織重試。此外,還可提供去除DNA修飾的ampDAP-seq流程。
(3)參考基因組用什么版本?
參考基因組建議優(yōu)先選擇您日常分析中常用的版本,如果后續(xù)需要將DAP-seq數(shù)據(jù)與其他實(shí)驗(yàn)數(shù)據(jù)(如RNA-seq、ATAC-seq等)進(jìn)行聯(lián)合分析,請(qǐng)務(wù)必保證所有數(shù)據(jù)使用相同版本的參考基因組,這樣才能確保分析結(jié)果的準(zhǔn)確性和一致性。
三、測(cè)序量和重復(fù)怎么定?
(1)測(cè)序量:
- 常規(guī)推薦:基因組的3X-5X。
- 需增加測(cè)序量的情況:
- 物種與參考基因組匹配度低,導(dǎo)致比對(duì)率低。
- 根部組織微生物含量高,可能降低比對(duì)率。
(2)重復(fù)設(shè)置:
我們的標(biāo)準(zhǔn)流程包含一個(gè)input對(duì)照和兩個(gè)技術(shù)重復(fù),無(wú)需額外設(shè)置重復(fù),可滿足文章發(fā)表需求(目前合作項(xiàng)目已發(fā)表于多個(gè)層次期刊)。
小知識(shí):input對(duì)照是什么?
Input對(duì)照是親和純化前的文庫(kù),即基因組DNA文庫(kù),作用是在分析時(shí)降低背景噪音。
四、特殊情況說(shuō)明
(1)哪些樣品不能做?
- 無(wú)參考基因組的物種。
- 轉(zhuǎn)錄因子無(wú)法在體外表達(dá)的情況。
除上述兩種,我們會(huì)提供可行性分析報(bào)告供參考。
(2)為什么有些基因家族成功率低?
部分轉(zhuǎn)錄因子需要和其他蛋白形成復(fù)合體才能與DNA結(jié)合,這些蛋白的實(shí)驗(yàn)風(fēng)險(xiǎn)比較高。
五、分析結(jié)果包含哪些內(nèi)容?
藍(lán)景科信DAP-seq的生信分析包含以下內(nèi)容:
1. 原始數(shù)據(jù)處理(去接頭、污染序列及低質(zhì)量reads)
2. 數(shù)據(jù)產(chǎn)出統(tǒng)計(jì)
3. 參考序列比對(duì)分析
4. 測(cè)序reads富集區(qū)域掃描(peak calling)
5. Peak在基因功能元件上的分布統(tǒng)計(jì)
6. Peak序列模式發(fā)掘(motif search)
7. 已知motif注釋
8. Peak相關(guān)基因鑒定
9. Peak相關(guān)基因的GO和KEGG富集分析
10. 測(cè)序數(shù)據(jù)的可視化分析
六、DAP-seq、ChIP-seq、Cut&Tag怎么選?

選擇建議:
對(duì)于ChIP實(shí)驗(yàn),需要足夠多的蛋白,為此常常將該TF過(guò)表達(dá),然后在特定組織部位獲得該蛋白,同時(shí)需要特異性的抗體,這兩點(diǎn)關(guān)系到實(shí)驗(yàn)的成功與否。Cut&Tag相比ChIP-seq的優(yōu)勢(shì)是樣本投入量少,信噪比高,但是同樣需要抗體,而且對(duì)樣本的活性狀態(tài)要求很高,不兼容長(zhǎng)期凍存樣本。如果您已有轉(zhuǎn)基因材料,且有ChIP級(jí)別抗體的話,ChIP實(shí)驗(yàn)還是值得嘗試的,畢竟能夠拿到體內(nèi)結(jié)果,若難以滿足上述條件,且時(shí)間、經(jīng)費(fèi)有限,建議您優(yōu)先考慮DAP-seq實(shí)驗(yàn)。
七、結(jié)果如何驗(yàn)證?
拿到結(jié)果之后需要挑選您感興趣的靶基因,之后就要開(kāi)始驗(yàn)證環(huán)節(jié),文獻(xiàn)中常用的驗(yàn)證實(shí)驗(yàn)方法包括:ChIP-qPCR、酵母單雜交、EMSA、雙熒光素酶報(bào)告實(shí)驗(yàn),我們可提供相關(guān)技術(shù)支持。
八、有哪些成功案例?
藍(lán)景科信已完成200+物種,3000+轉(zhuǎn)錄因子的實(shí)驗(yàn),周期短,口碑好,助力客戶發(fā)表高分文章Cell,Molecular Plant,Plant Biotechnology Journal,Plant Cell,PNAS,Plant Communications,Journal of Integrative Plant Biology,New Phytologist,International Journal of Biological Macromolecules,Horticulture Research,Plant Physiology等。
已做物種:


相關(guān)產(chǎn)品
免責(zé)聲明
客服熱線: 13199863987
加盟熱線: 13199863987
媒體合作: 0571-87759945
投訴熱線: 0571-87759942

下載儀表站APP

Ybzhan手機(jī)版

Ybzhan公眾號(hào)

Ybzhan小程序